新冠疫苗最新消息(美国疫苗临床试验已经开始)
3月16日,第一批临床试验志愿者在美国西雅图接受注射。该疫苗项目的发起者是美国国立卫生研究院(NIH)和美国生物科技公司Moderna;前者同时是项目资助方。
人体试验的开始,意味着距离疫苗上市又近了一步,但总耗时仍将远超公众的期望。“至少还需要一年”才能问世,这是世界卫生组织总干事谭德塞给出的乐观估计。
虽然大家都希望疫情尽快结束,但疫情的离开却也可能终结疫苗的研发。毕竟,2003年SARS疫苗就是这样“胎死腹中”的。
北京科兴生物制品有限公司曾参与研发SARS疫苗,并于2004年12月5日完成了共36名受试者的一期临床试验。然而,早在2003年7月,此次非典疫情就基本结束,已经没有患者可供试验,因此疫苗的二期临床试验不得不就此终止。“科兴不仅颗粒无收,且为此停掉了成品疫苗生产线,出现了持续亏损,”《财经》杂志写道。
技术问题的攻克至关重要,但决定一支疫苗能否成功上市的因素,比我们预想的要复杂。
一般情况下,新冠疫苗从研发到上市至少8年
科兴的一期临床试验一共花费了8个月,虽然没追上非典疫情,但相对于普通疫苗的研发速度来说,已经算快的了。据国家药监局科普,“通常,一个疫苗从研发到上市,至少要经过8年甚至20多年漫长的研发历程。”
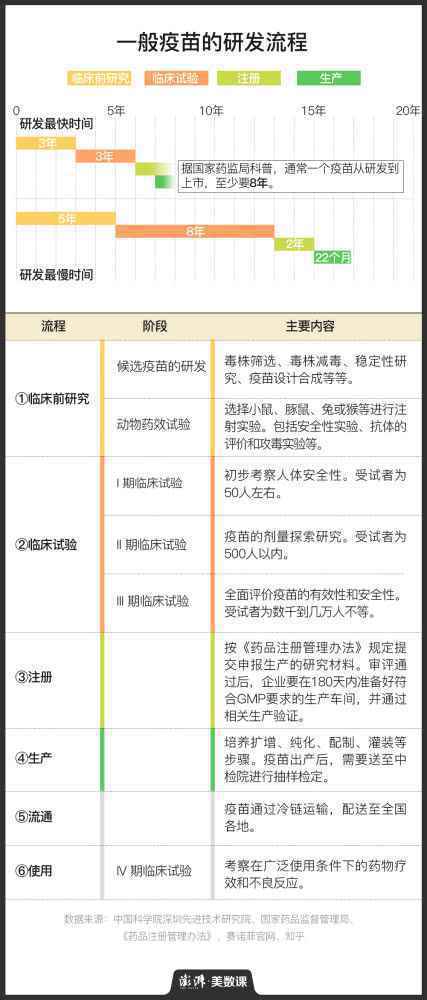
上图展示了一支普通疫苗的研发流程。如图所示,非典时期北京科兴完成的一期临床试验,是最初步的人体试验,用于探索人体对疫苗的耐受程度。这之后的二期和三期试验,则重点探索疫苗的剂量及安全性。其中,三期临床试验结果是疫苗注册获批的基础,因为它是一个随机、多地、大量、双盲的试验。
新冠疫苗最新消息:这三期新冠疫苗临床试验做下来,一般要3到8年,有的甚至长达10年以上。
在我国,加快疫苗上市的一个办法,是通过国家出台的相关政策,申请缩短审批时间,比如优先审批通道、特殊审批等等。丁香园Insight数据库负责人赵仲告诉澎湃新闻,目前临床试验申请实行默认许可制,一般60个工作日内可出结果。但疫情期间,机构可向国家药监局药品审评中心申请加速。
另外,疫苗的注册审批也可通过优先审批或特殊审批通道加速获批。2019年国家药监局审批疫苗的时间大概要2年左右,但17年注册成功的埃博拉疫苗,借由相关政策,产品报上市的审评审批时间不到200天。
但临床试验的时间是很难被大量压缩的。筛选合适的病人入组需要时间,观察病人对疫苗的免疫反应也需要时间。“这些都是必要的时间,所以现在说一年内就能上市的疫苗,通常来讲是不严谨的。”赵仲解释道。
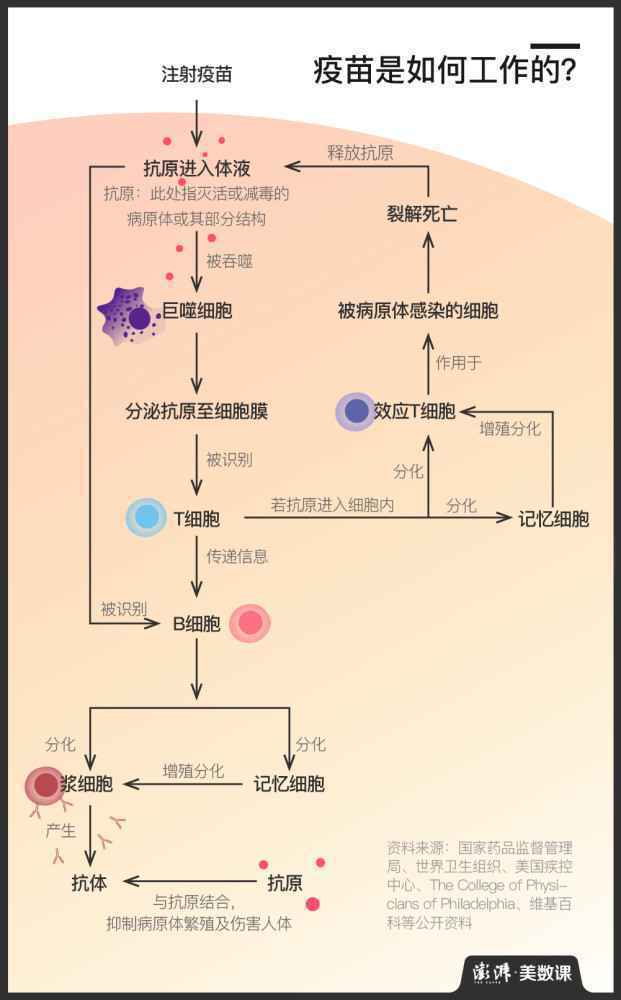
这是由疫苗的运作原理决定的。简单地说,疫苗是通过将灭活或减毒的病原体或其部分结构注入人或动物体内,唤醒免疫细胞辨认、记忆抗原并生成相应的抗体,来使人或动物收获对某种疾病的免疫力的。其效用依赖于被注入机体后所诱发的免疫应答,因而研发及临床试验的各个环节都充满了未知。而如果想要打造一款在安全性、免疫反应强度、免疫持续期、时间及经济成本等方面均表现出色的疫苗,耗时长更是必然的。
以往对SARS和MERS的研究,加速这次新冠疫苗研发

